最終更新日:2020年11月13日
重症大動脈弁狭窄症
重症大動脈弁狭窄症とは?表示
重症大動脈弁狭窄症は胎児および新生児の生命にかかわる重篤な症状を引き起こす先天性心疾患の1つであり、出生1万あたり3.5人の発生頻度と報告されています1)。左室の流出路の狭窄によって心負荷が増大するため、胎児期に左室機能が高度に低下して左心低形成症候群になっていく例があります。左心低形成症候群は近年の医療の進歩によって治療成績が向上しましたが、根治術となるフォンタン手術に到達する例は60~70%であり、右心室による単心室循環となるため術後の問題点もあります。
重症大動脈弁狭窄症の診断は?表示
胎児心エコーによるスクリーニングで疑われ、精査によって診断されます。重症大動脈弁狭窄症は大動脈弁の可動が不良で大動脈弁を通過する血流が加速することによって診断されますが、初期には診断が難しいことがあります。進行すると左室の拡大や僧帽弁逆流などを生じます。
重症大動脈弁狭窄症の胎児治療は?表示
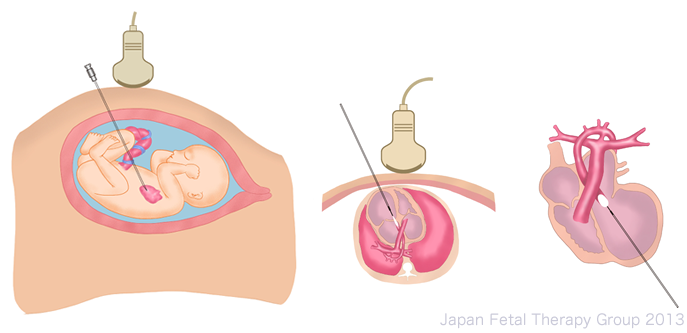
重症大動脈弁狭窄症は、胎内で左室流出路狭窄を解除できれば、左心低形成症候群への進行を防ぐことができる可能性がある。このため2000年よりボストンを中心に、出生後の二心室型の循環動態の確立を目指して、妊娠中期の重症大動脈弁狭窄症に対する胎児治療が試みられてきました2)。母体と胎児に麻酔をかけた後、母体の腹壁から胎児を穿刺に適した位置に調整します。超音波で観察しながら心室心尖部側から狭窄部位に向かって穿刺を行い、バルーンで拡張を行います3)。
重症大動脈弁狭窄症の治療成績と予後は?表示
重症大動脈弁狭窄に対するバルーン弁形成術は、技術的には73~94%で成功していますが、二心室型の循環動態を確立できるのはそのうち32~59%であり、子宮内胎児死亡が10%程度と報告されています4)5)。2014年のアメリカ心臓協会の提言では、重症大動脈弁狭窄に対する胎児治療によるベネフィットはリスクと同等かそれより高いと考えられ、治療を考慮しても良いとしています6)。
参考文献表示
- Mäkikallio K, et al: Fetal aortic valve stenosis and the evolution of hypoplastic left heart syndrome: patient selection for fetal intervention. Circulation 2006; 21: 1401-1405.
- Tworetzky W, et al. Balloon dilation of severe aortic stenosis in the fetus: Potential for prevention of HLHS: Candidate selection, technique, and results of successful intervention. Circulation 2004; 110: 2125-2131
- Marshall AC, et al. Results of in utero atrial septoplasty in fetuses with hypoplastic left heart syndrome. Prenat Diagn 2008; 28: 1023-1028
Donofrio MT, et al: Diagnosis and treatment of fetal cardiac disease. A scientific statement from the American Heart Association. Circulation 2014; 129: 2183-2242.
- Friedman KG, et al. Improved technical success, postnatal outcome and refined predictors of outcome for fetal aortic valvuloplasty. Ultrasound Obstet Gynecol 2018; 52: 212–220
- Kovacevic A, et al. Fetal hemodynamic response to aortic valvuloplasty and postnatal outcome: a European multicenter study. Ultrasound Obstet Gynecol 2018; 52: 221–229
- Donofrio MT, et al. Diagnosis and treatment of fetal cardiac disease. A scientific statement from the American Heart Association. Circulation 2014; 129: 2183-2242.
